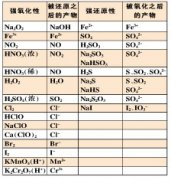
一、递变性
1.原子的电子层数逐渐增多、原子的半径逐渐增大、元素的非金属性逐渐减弱。
2.单质颜色逐渐加深,熔沸点逐渐升高,状态有气体、液体、固体。
3.元素的氧化性逐渐减弱,与H2反应从易到难,与H2O反应程度逐渐减弱。
4.阴离子的还原性逐渐增强。
5.氢化物的熔沸点逐渐升高,稳定性逐渐减弱,其水溶液的酸性逐渐增强。
6.AgX的溶解度逐渐减小,颜色逐渐加深,感光性逐渐增强。
二、相似性
1.最外层都有7个电子,得一个电子形成稳定结构,因此负价均为-1价。
2.氯、溴、碘的最高正价为+7价,还有+1、+3、+5价。
3.单质:均为双原子分子X2;均能与H2化合生成HX;均能与金属单质化合生成盐;除氟外,与水反应生成HX和HXO;均能与碱溶液反应;除氟外,均得可到“卤水”。
4.卤化氢均为无色气体,均易溶于水,在潮湿空气中均形成白雾。
5.卤化氢的水溶液均显酸性,除HF为弱酸外,其余均为强酸。
6.除F-外,Cl-、Br-、I-均与Ag+生成AgX沉淀,且不溶于稀硝酸。
7.除F-外,Cl-、Br-、I-均有还原性。
8.除AgF外,AgX均有感光性;除CaF2外,CaX2均易溶于水。
9.除F2外,X2均可用浓HX与MnO2反应制备。
三、特殊性
1.F元素无正价,无含氧酸。
2.F2能与某些稀有气体生成氟化物(XeF4等);F2能置换出水中的氧(2F2+2H2O??4HF+O2);在水溶液中F2不能置换出其他卤素。
3.F2只能用电解法制取。
4.HF为弱酸,能腐蚀玻璃(SiO2+4HF??SiF4-+2H2O)。
5.AgF易溶,无感光性,CaF2难溶。
6.Cl2易液化;Br2是唯一的一种常温下呈液态的非金属,易挥发;I2易升华,使淀粉溶液变蓝。
7.HF、HCl可用浓硫酸制取(CaF2+H2SO4(浓) ?D ?CaSO4+2HF-);
HBr、HI只能用浓磷酸制取(NaBr+H3PO4(浓) ?D ?NaH2PO4+HBr-);
8.在HX中,HF的熔沸点为最高。
当前位置:主页 > 考试 > 学历类 > 高考 > 各科备考 > 高考化学备考 > >
高中化学知识点:卤族元素递变性相似性
来源::未知 | 作者:nba竞彩投注app-nba竞猜app哪个好-正规软件下载* | 本文已影响 人
- 上一篇:高考化学选择题“配平法”是否靠谱
- 下一篇:化学学习记忆口诀
随机阅读
- [高考化学备考] 怎样掌握高中化学学习方法
- [高考化学备考] 化学解决计算题失分的步骤
- [高考化学备考] 高考化学知识点:常见的氧
- [高考化学备考] 高中化学学习中总结的四个
- [高考化学备考] 高三化学知识点 化学反应
- [高考化学备考] 高考化学复习指导:轻重分
- [高考化学备考] 高考化学知识点:带颜色的
- [高考化学备考] 怎样做化学元素推断题
- [高考化学备考] 理综化学大题高分技巧
- [高考化学备考] 高中化学离子方程式判断
- [高考化学备考] 高中化学方程式总结
- [高考化学备考] 高考化学学习防范:化学知
- [高考化学备考] 高中化学易错知识点
- [高考化学备考] 高考化学复习方法: 改变
- [高考化学备考] 高三化学知识点 电解质
- [高考化学备考] 化学教学中渗透绿色化学教